
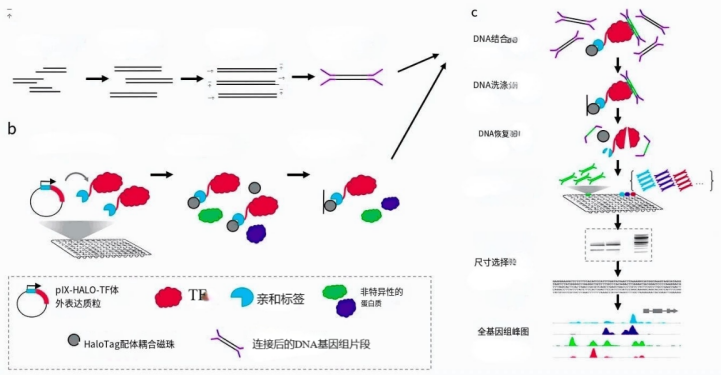
DNA 亲和纯化测序(Dap-seq, DNA Affinity Purification sequencing),通过体外构建表达转录因子(TF, Transcription Factor)蛋白,与目标基因组片段结合,针对把目的蛋白所结合的基因组DNA片段进行富集。通过与高通量测序技术的结合,对 DAP 后的 DNA 产物进行测序分析,从全基因组范围内寻找目的蛋白的 DNA 结合位点,以高效率的测序手段得到高通量的数据结果。
转录因子(TF)在动植物的生长发育及其对外界环境的反应中起着重要的调控作用。转录因子是指能够与顺式作用元件发生特异性相互作用,并对基因的转录具有激活或抑制作用的DNA 结合蛋白。在植物的生长发育和对逆境的应对中,转录因子扮演着关键的调控角色。在植物生长发育和逆境应答等关键过程中,转录因子起着非常重要的调控作用。转录因子结合位点是转录因子调节基因表达时,与基因的模板链发生结合的特定区域,即与转录因子结合的 DNA 片段,长度通常在 5~20 bp 之间。一个转录因子通常可以同时调控 多个基因,其在不同基因上的结合位点具有一定的保守性,但又并非完全相同。
体外表达的蛋白和 DNA 进行亲和纯化,将与蛋白结合的DNA洗脱后进行高通量测序。其基本过程是将编码转录因子的 CDS 序列构建到含有亲和标签(Halo-Tag)的载体中,构建蛋白表达载体,进行体外蛋白表达,形成转录因子和亲和标签的融合蛋白;提取样品的基因组 DNA ,构建 DNA 文库。然后将体外表达的带有亲和标签的转录因子和 DNA 文库进行结合,随后把结合的 DNA 洗脱后上机测序。
1、非模式生物的转录调控研究利器:快速绘制转录因子调控靶向 DNA 区域的顺反组和表观组图谱的文章,鉴定转录因子的结合位点,并揭示了甲基化状态影响转录因子的结合模式;
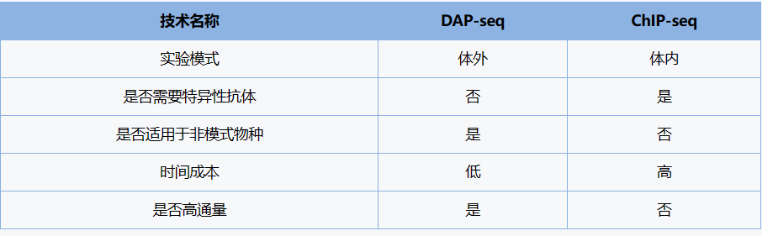
2、挖掘 TFBS 的利器:Dap-Seq 技术结合了蛋白质的体外表达和高通量测序,无需为每个转录因子制备特异性抗体。因此,它具备快速、高通量和成本效益的特点,并且比 ChIP-seq 技术更容易扩展。该方法适用于大部分植物,为科学家提供了一种研究调控序列中的遗传或表观遗传变异如何影响植物性状和机制的途径;
3、 适用于一些特殊的样本:
(1)抗体难以获得的样本——有些物种(尤其是植物)中的转录因子没有对应的 ChIP 级别抗体或者没有成熟的转基因体系无法使用标签抗体,而自制抗体周期较长且难度较大;
(2)染色质提取困难的样本——有些植物的果实、花、茶叶等糖酚含量较高,提取染色质难度较大;
(3)蛋白表达丰度低的样本——植物中的转录因子表达微弱且存在时空表达特性;
4、单个转录因子的结合位点鉴定;
5、同源二聚体、异源二聚体或异源四聚体的结合位点鉴定。
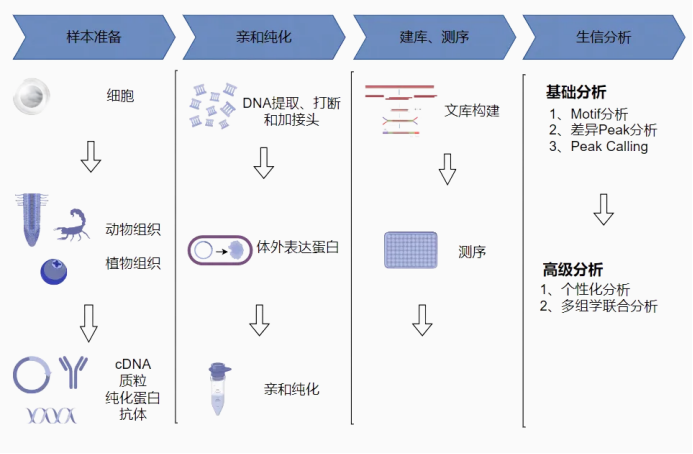
主要步骤包括 DNA 文库构建、蛋白表达、蛋白与文库的结合反应、文库 PCR 加接头及定量检测、上机测序、生信分析等。
1、组织材料的全基因组 DNA 提取,并构建 DNA 文库;
2、构建转录因子的 Halo-tag 体外表达质粒,利用麦胚系统进行蛋白表达;
3、混合蛋白与文库,磁珠富集与目的蛋白结合的 DNA 片段;
4、多次洗涤,除去非特异结合的染色质,并纯化复合体;
5、纯化 DNA 片段,测序分析。
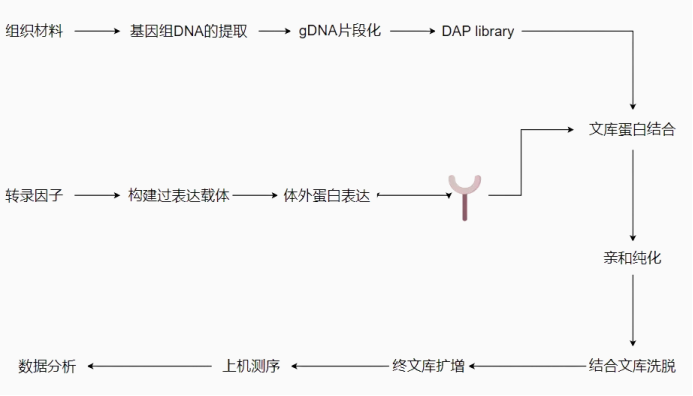
需要您提供:1、组织材料或者是提取好的基因组 DNA ;2、含有转录因子 CDS 序列的质粒。
1、高通量检测转录因子或 DNA 结合蛋白在基因组上的结合位点;
2、可用于模式物种和非模式物种的研究,无需特异性抗体;
3、100+ 物种,1000+ 转录因子的实验经验;
4、为您提供完整的 Dap-seq 解决方案。
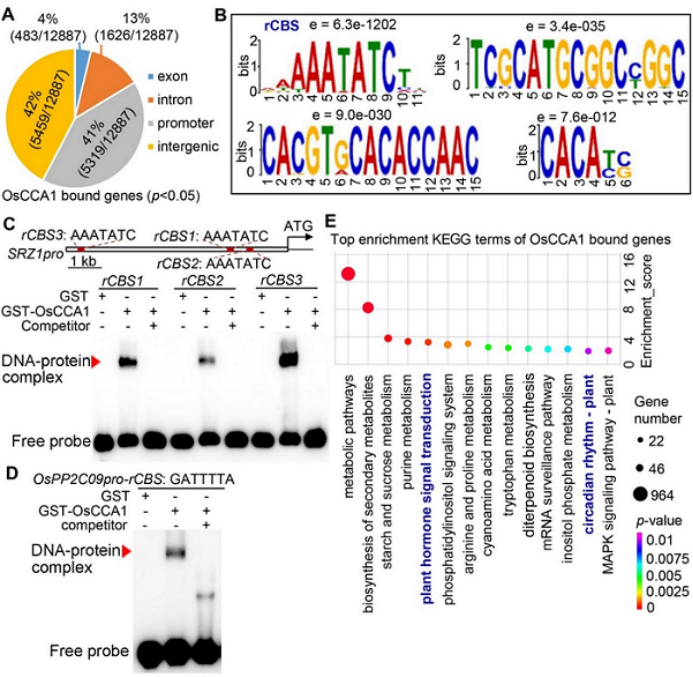
(Wei et al., 2022, Plant Physiol)
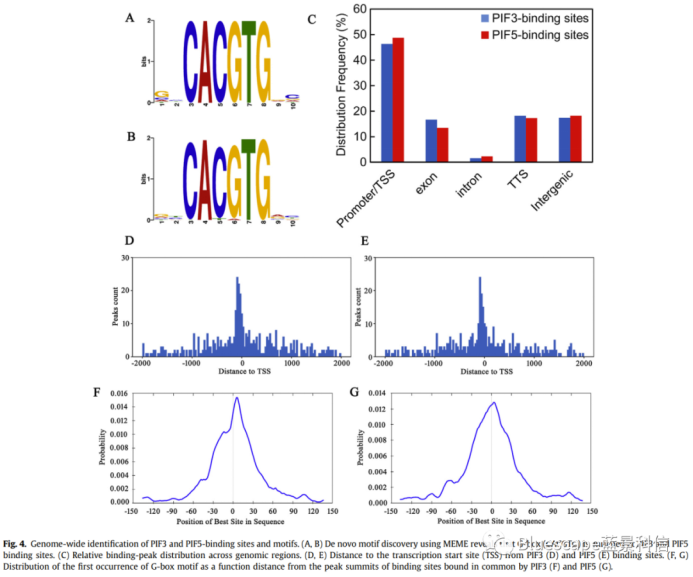
(Liang et al., 2020, Biochem Biophys Res Commun)